剃刃锋利,度之不易。-- 威廉·萨默塞特·毛姆
(一) 手术机器人市场初步介绍
手术机器人,一度被称为刀尖上的科技革新。手术机器人的定义通常为集医学、生物力学、机械学、计算机科学、微电子学等多学科前沿技术为一体的大型医疗器械,其借助控制台、成像系统和机械臂,以微创的手术形式,协助医生实施精准控制并完成复杂的外科手术。与开放手术及传统微创手术相比,它有诸多优势:首先,手术机器人有效减小了手术伤口创面面积,使得患者术后恢复较快,减少术后并发症的发生;其次,手术机器人灵活的机器臂提高了手术精准度,保证了手术结果的稳定性;最后,手术机器人减少了外科医生的体力消耗,缩短了医生的学习曲线,还减少了病人的辐射暴露。
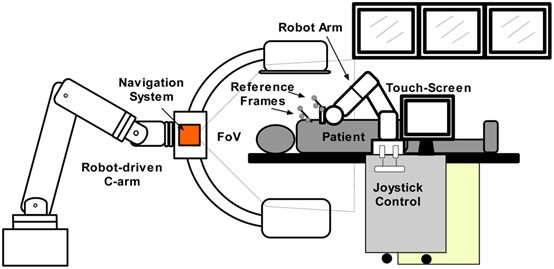
图1 手术机器人系统图 1
全球手术机器人行业正经历高速增长,截至2021年底,直觉外科、史赛克、美敦力等多家境外公司的十余项手术机器人产品获得了国家药品监督管理局("NMPA")批准上市。与此同时,国产手术机器人也有产品上市,其代表性产品是:(1)于2016获得国家食品药品监督管理总局 2批准上市、由天智航研发的 骨科手术导航定位机器人(天玑), (2)于2021年10月获得NMPA批准上市、由威高研发的 腹腔内窥镜手术设备(妙手 -S),以及(3)于2022年1月获得NMPA批准上市、由微创机器人研发的 腔镜手术机器人(图迈)。对比2020年美国腔镜机器人13.3%的市场渗透率,中国腔镜机器人的渗透率仅为0.51% 3,因此,中国手术机器人市场才刚进入开发导入期,具有广阔的市场空间。根据Frost & Sullivan的统计4,各个细分领域手术机器人的的中国市场销量预测情况如下:
|
分类 |
治疗领域 |
已知复合年增长率 (2015-2020年) |
2025年预计中国市场规模 (单位:百万美金 ) |
|
腹腔镜手术机器人 |
泌尿外科、妇科、胸外科及普外 |
32.0% |
1,903.3 |
|
骨科手术机器人 |
关节置换、脊柱、创伤 |
/ |
348.0 |
|
泛血管手术机器人 |
心脏、脑部、外周血管相关 |
/ |
112.6 |
|
经自然腔道手术机器人 |
支气管镜、结肠镜、胃镜 |
/ |
75.0 |
|
经皮穿刺手术机器人 |
早期肺癌、乳腺癌、前列腺癌 |
29.5% |
198.4 |
|
神经外科手术机器人等其他 |
开颅手术等 |
42.6% |
368.3 |
(二)手术机器人的核心技术和智能化发展趋势
根据复星恒利出品的研究报告 5,以腔镜手术机器人为例,手术机器人所涉及的核心技术如下图所示:
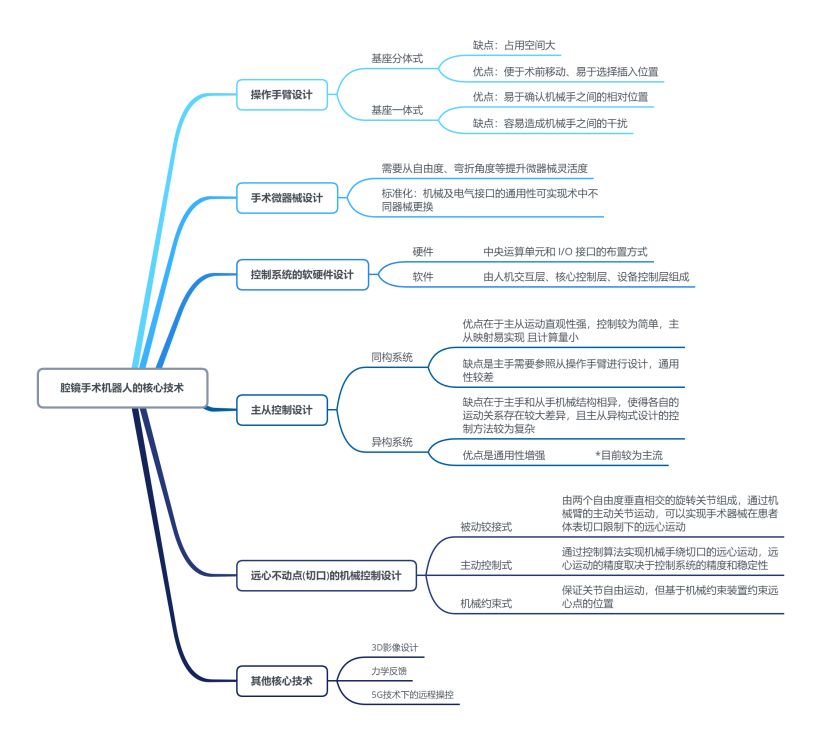
图2 腔镜手术机器人核心技术图示
从上图来看,手术机器人涉及多种技术,技术壁垒较高。尽管我国自研的手术机器人产品在专利积累数量以及临床手术效果尚未完全达到达芬奇等境外成熟手术机器人产品的同等水准,但国产腔镜手术机器人和骨科手术机器人已经初步攻克了相关底层核心技术,并在力学反馈和远程操控等新型功能上具备一定的技术竞争优势。
另一方面,展望未来,手术机器人还可以导入人工智能技术,除了将外科手术做得更加精准高效之外,还将手术行为从一个定性的动作转变为可量化的标准化操作程序和数据信息,使得外科手术的数字化与智能化成为可能。具体而言,机械臂和微器械所搜集的各种电信号,通过大样本数据的分析与优化,反过来可以进一步优化手术流程,通过人工智能技术的反复学习,AI手术机器人有望实现人工智能辅助手术进展功能甚至是全人工智能操作。AI手术机器人未来可能发展成为串联起智能检查、术前规划、术中知道、术后分析的一体化交互载体与输出平台。
(三) 手术机器人的常见法律问题
3.1 产品作为医疗器械的申报注册流程
手术机器人与传统医疗器械不同,其本身复杂的结构和模块系多个传统医疗器械的集合,难以根据现有医疗器械分类目录直接确定其类别,根据《医疗器械监督管理条例》,对新研制的尚未列入分类目录的医疗器械,申请人可以依照第三类医疗器械产品注册的规定直接申请产品注册,也可以依据分类规则判断产品类别并向国务院药品监督管理部门申请类别确认后依照规定申请产品注册或者进行产品备案。手术机器人本身属于有源手术器械和植入式医疗器械,对人体具有较高风险性,根据现行有效的医疗器械分类目录,有源手术器械目录中除少量项目 6外多为第三类医疗器械。目前,中国境内已投入上市使用的手术机器人均作为第三类医疗器械予以监管。此外,根据国家药品监督管理局医疗器械技术审评中心(CMDE)发布的《腹腔内窥镜手术系统技术审评要点》(" 审评要点"),腹腔内窥镜手术系统明确作为第三类医疗器械进行管理。审评要点规定的其他重要事项如下所示:
|
产品配置 |
标准配置包括医生控制台、患者手术平台,可选配置包括影像处理平台、三维腹腔内窥镜(简称内窥镜)、手术器械等 |
|
核心原理 |
主从遥操作,即操作者操控医生控制台上的主控制器,经传感器测量、主从映射变化、从手逆运动学等机器人学原理,计算从手各关键的位置和速度,以实现对主手运动的精确复制,从而精确控制患者手术平台上的手术器械并完成手术 |
|
注册单元 |
|
|
产品研究 |
化学和物理性能研究、电气系统安全性研究、辐射安全研究、软件研究、生物学特性研究、清洁消毒灭菌研究、动物试验研究、稳定性研究、人因设计/可用性研究等 |
因手术机器人系集多种前沿技术为一体的大型医疗器械,一项产品可以汇集、使用多项专利技术,该等具有前沿性、创新性的特点与国家鼓励医疗器械的研究与创新,推动医疗器械产业高质量发展的目标完美契合,因此也可以作为创新医疗器械进行申报注册。在符合创新医疗器械适用条件的前提下,可采用创新医疗器械审查通道在标准不降低、程序不减少的前提下,享受优先办理的权利。就创新医疗器械特别审查程序的适用条件可参照本系列第(二)篇《脑机接口技术在医疗场景应用的法律问题》。创新医疗器械特备审查程序的申请流程可参考如下图示:
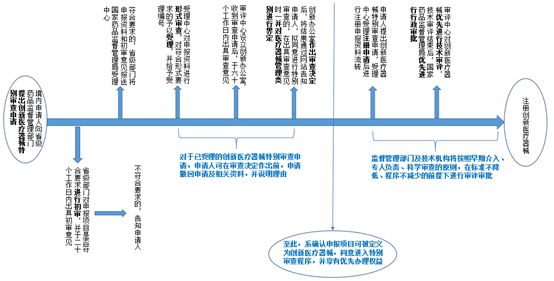
图3创新医疗器械申请流程图示 7
进口的手术机器人产品如果有意在中国市场销售,境外企业除了作为注册申请人向NMPA履行相应的注册申请资料提供以及证明义务外,还需指定境内企业法人作为其境内代理人,向NMPA递交前述资料。境内代理人还应协助境外注册人履行:建立与产品相适应的质量管理体系并保持有效运行;制定上市后研究和风险管控计划并保证有效实施;依法开展不良事件监测和再评价;建立并执行产品追溯和召回制度;国务院药品监督管理部门规定的其他义务。值得留意的是,NMPA于2022年6月29日发布《支持港澳医疗器械注册人在大湾区内地9市生产医疗器械实施方案》,这标志着进口医疗器械注册人在我国的跨境委托生产制度已投入试点并将逐步推广。这些与进口医疗器械上市和生产相关的有利监管政策均对手术机器人产品的跨境合作有促进作用。
3.2 开展临床试验过程中的受试者个人信息保护
从规范性层面来看,《医疗器械临床试验质量管理规范》《世界医学大会赫尔辛基宣言》与《个人信息保护法》(" 个保法")均明确要求申办者对受试者个人信息处理、知情权及隐私权保护承担相关义务。研发企业需特别关注如下与个人信息处理相关的法律问题:
(1) 敏感个人信息处理前需单独取得个人同意
个保法明确规定处理敏感个人信息 8应当取得个人的单独同意,在处理该等敏感个人信息之前,还应当以清晰易懂的语言准确地向个人告知包括信息处理者名称、联系方式、处理方式、处理目的、信息保存期限、处理敏感个人信息的必要性以及对个人权益的影响等要素。倘若涉及多区域临床试验或者国际合作临床试验的,还需考虑是否可能将境内受试者的个人信息分享至境外主体,倘若需要传输至境外,亦应当向受试者个人告知境外接收方的名称或者姓名、联系方式、处理目的、处理方式、个人信息的种类以及个人向境外接收方行使个保法规定权利的方式和程序等事项,并取得个人的单独同意。
一般而言,受试者参与临床试验之前签署的知情同意书内包含了关于个人信息保护的专项条款,用以说明受试者可能被收集到的个人信息种类以及该等被收集的个人信息之储存地点、查阅权限、共享范围等,而在签署知情同意书之前,临床试验机构或者研究者团队亦会详细予以说明。我们理解,前述各项操作(包括受试者在知悉详情后签署该等知情同意书)一定程度上可被理解为取得受试者对处理其个人信息的单独同意的有效途径,但是否一定达到了取得受试者处理其敏感个人信息之单独同意的合规要求,还需根据知情同意书内个人信息保护专项条款之表述及范围进一步判断。
为有效规避违反敏感个人信息处理相关法律法规之风险,我们就知情同意书的取得步骤以及个人信息保护专项条款提出如下建议供参考:
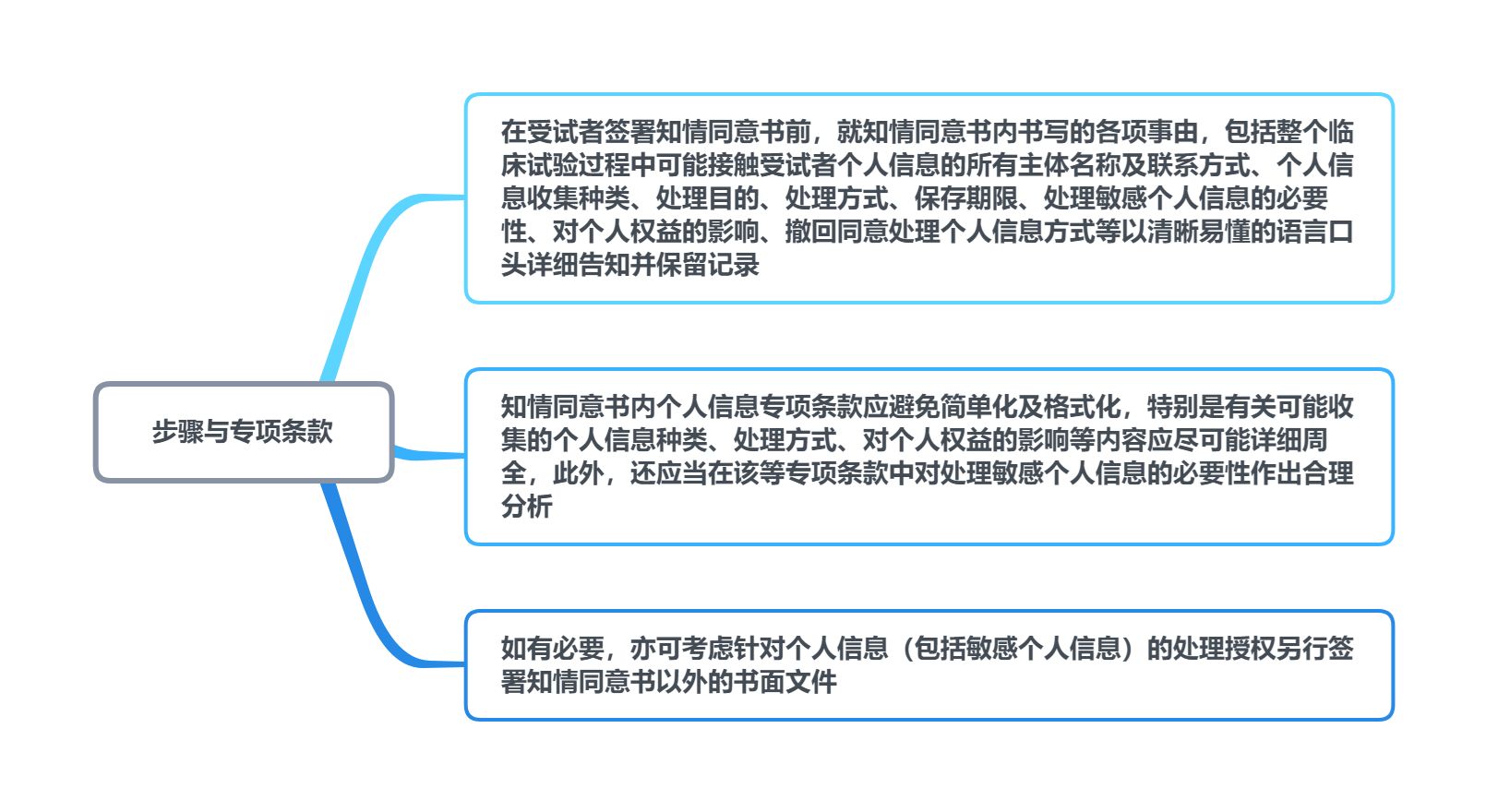
图4 个人信息保护 建议图示
(2) 临床试验申办者作为个人信息处理者需承担的评估工作
根据个保法,临床试验申办者作为敏感个人信息处理者,可能涉及如下评估工作:
- 向境外提供特定数量个人信息的安全评估:假如多区域临床试验 9的主要数据分析中心在境外,将会涉及境内受试者敏感个人信息出境的问题,开展国际合作临床试验时同样可能涉及数据出境问题。传输个人信息达到国家网信部门规定数量 10的个人信息处理者,应当将在中华人民共和国境内收集和产生的个人信息存储在境内,确需向境外提供的,应当通过国家网信部门组织的安全评估。其他情况则由专业机构进行个人信息保护认证或者与境外接收方签订合同约定权利义务即可。需注意的是,在申报数据出境安全评估前,临床试验申办者还应当开展数据出境风险自评估,并将数据出境风险自评估报告于申请数据出境安全评估时提交至网信部门。此外,还需注意是否可能涉及人类遗传资源 11材料的出境,如涉及,则应当由合作双方共同提出申请并经国务院科学技术主管部门批准,如不涉及出境仅涉及采集,则应当于开展临床试验之前将拟使用的人类遗传资源种类、数量及其用途向国务院科学技术行政部门备案,否则,将招致数额不小的罚款 12。
- 个人信息保护影响 评估:有下列情形之一的,个人信息处理者应当事前进行个人信息保护影响评估,并对处理情况进行记录:a)处理敏感个人信息;b)利用个人信息进行自动化决策;c)委托处理个人信息、向其他个人信息处理者提供个人信息、公开个人信息;d)向境外提供个人信息;e)其他对个人权益有重大影响的个人信息处理活动。我们理解,研发企业作为临床试验申办者,一旦成为敏感个人信息的处理主体,本身即应当开展个人信息保护影响评估工作13,该等报告及处理情况记录应当至少保存三年。
3.3 委托CRO及 SMO进行临床试验的关注要点
手术机器人作为创新医疗器械,其研发与获批上市是一项高投入、长周期的系统性竞赛,其中,为确保临床性研究和临床试验的顺利实施,研发企业往往会寻求合同研究组织(Contract Research Organization,CRO)及临床试验现场管理组织(Site Management Organization,SMO)14提供的第三方研发协助服务,将临床试验运营管理、临床试验现场管理等与临床相关的非核心研发性事务委托给CRO及或SMO最终落地实施。
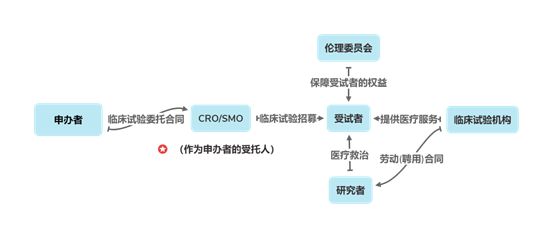
图5 医疗器械临床试验各主体关系图
根据《药品研究机构登记备案管理办法(试行)》( "备案办法"),凡在我国为申请药品临床试验和生产上市而从事研究的机构(明确包括合同研究组织),应依照该办法向省级药品监督管理部分申请登记备案。但在实践操作中,部分地区已不再执行备案办法,部分地区已取消该等备案,CRO机构开展与临床试验相关的服务活动,无法依据备案办法的规定向当地药品监督管理部门办理药品研究机构的登记备案工作。结合公开查询到的CRO及SMO行业已上市案例的披露资料 15,发行人的保荐机构及律师通常观点为NMPA未针对CRO与SMO行业设置准入政策,CRO及SMO企业暂无需就临床试验的运营及现场管理服务取得特别的资质或许可。
CRO与SMO作为一种专业性较强的合同外包服务,项目服务价格较昂贵且涉及到的服务内容也十分复杂,手术机器人的研发企业在与CRO和SMO签署临床试验委托合同时应注意如下要点:
|
要点 |
具体内容 |
|
付费模式 |
|
|
成果归属 |
应明确约定16项目中的研究成果(包括任何数据、信息及资料)及其对应的全部知识产权应独立归属于委托方/申办方。 |
|
服务内容 |
|
|
责任承担 |
|
|
受试者信息保护 |
|
|
分包及外协 |
项目执行过程中若涉及分包及外协,则建议应事先取得申办者的书面许可,且申办者有权对于分包及外协的原因、必要性和关键人员(如:CRA和CRC)的替换进行审核。 |
3.4
手术机器人作为大型医用设备在终端销售时需要关注医疗机构是否获得配置证
我国对于大型医用设备的安装使用实施分级分类配置规划和配置许可管理的制度,医疗机构若拟配置属于《大型医用设备配置许可管理目录》的产品需向卫生主管部门申请并取得配置许可证。根据2018年最新目录 17,"内窥镜手术器械控制系统"手术机器人属于乙类设备,由省级卫健委进行配置管理,具体而言,医疗机构在采购前必须征得省级卫生健康行政部门的批准并取得配置证。医疗机构采购大型医用设备时,需要开展工作的一般流程如下图所示:
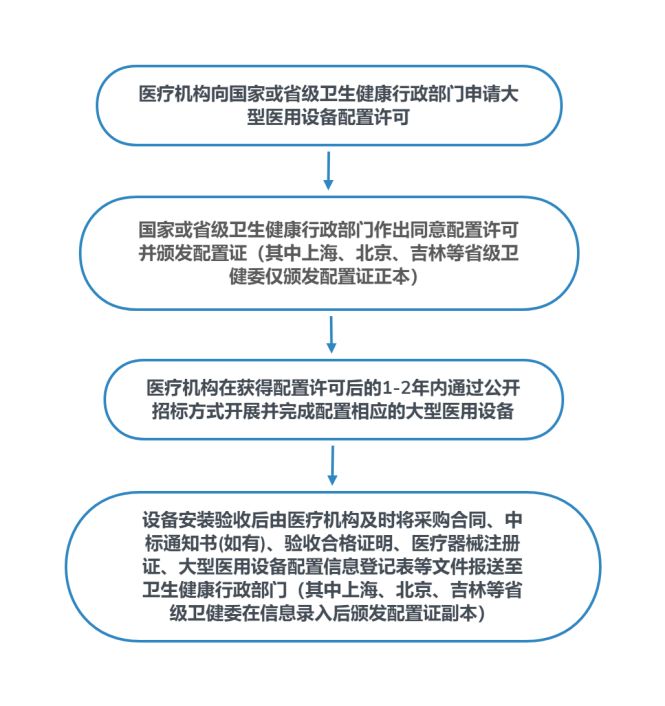
图6 医疗机构采购大型医用设备一般流程图
对于医院采购大型医用设备的监管正在逐步放松,根据国家卫健委于2021年6月30日下发的《社会办医疗机构大型医用设备配置"证照分离"改革实施方案》,(1)民营医疗机构的乙类大型医用设备配置许可实行告知承诺制,即一次性告知申请人配置乙类大型医用设备许可条件和所需材料,对申请人自愿承诺符合许可条件并按要求提交材料的,当场作出许可决定;(2)自贸区内民营医疗机构乙类大型医用设备由审批改为备案管理,不受大型医用设备配置规划限制。
此外,结合公开查询到的大型医用设备企业的A股IPO申报材料 18,终端客户对采购设备是否拥有配置证成为交易所与监管部门在发行上市审核中关注的法律问题之一。所幸在之前的上市案例中,终端客户中如果未提供配置证的医疗机构数目及收入均占比不高的,该等问题则不会构成发行人上市的实质性障碍。此外,发行人律师还认为,终端客户未取得配置证属于违反管理性强制性规定而非违反效力性强制性规定,结合司法判例,未取得配置证并不能影响发行人与终端客户或经销商签署的销售合同的有效订立。
手术机器人企业在后续市场化销售中,应留意审核并留存终端客户的配置证情况,应积极拓展公立医院和民营医院等多元化终端客户。
(四) 结语
我们分别聚焦AI康复机器人、BCI设备和手术机器人撰写了一系列智能器械的有关文章。人工智能技术正在推动各类医疗器械不断推出创新产品,一方面在NMPA各类政策的助力下,创新器械的上市批准规则与审评要点愈加清晰,另一方面研发企业及行业投资者在关注技术创新的同时也应关注上下游供应关系、企业核心技术、临床试验、进出口管制与数据保护等方方面面的合规要求。希望本系列的文章可以对于中国智能医疗器械的从业者们有所参考和裨益。
律意见书,发行人律师分析回应了证监会关注的终端客户未取得配置证的相关法律风险。
Footnotes
1. Tovar-Arriaga, Saúl, José Emilio Vargas, Juan M. Ramos, Marco A. Aceves, Efren Gorrostieta, and Willi A. Kalender. 2012. "A Fully Sensorized Cooperative Robotic System for Surgical Interventions" Sensors 12, no. 7: 9423-9447. https://doi.org/10.3390/s120709423.
2. 2018年3月,第十三届全国人民代表大会第一次会议审议通过的《国务院机构改革方案》决定不再保留国家食品药品监督管理总局,设立国家药品监督管理局(NMPA)。
3. 健康界:《中国手术机器人行业研究报告(综述篇)》,2022年3月发布。
4. 详见微创机器人(02252.HK)招股说明书。
5. 何霜霖(复兴恒利研究部):《中国腔镜手术机器人和骨科手术机器人行业深度报告》,2021年12月发布。
6. 有源手术器械中如下项目不属于第三类医疗器械:超声手术设备附件;医用激光光纤;用于皮肤科、耳鼻喉科、妇科和肛肠科浅表部位的手术中对相应组织进行凝固、使组织变性和/或坏死的高频手术设备;用于体内器官、组织的离断、切除和/或建立吻合,适用于多种开放或微创的手术的电动吻合器等。
7. 图中,(1)受理中心指行政事项受理服务和投诉举报中心;(2)审评中心指医疗器械技术审评中心;(3)创新办公室指创新医疗器械审查办公室。
8. 临床实验中收集、记录的受试者信息涵盖了姓名、年龄、过往病历、各项化验指标、检查结果、手术方案等,该等医疗健康相关的个人数据一旦泄露或者非法使用,容易导致受试者的人格尊严受到侵害或者人身、财产安全受到危害,系属于敏感个人信息。
9. 多中心临床试验在不同的国家或者地区实施时,为多区域临床试验。
10. 详见《数据出境安全评估办法》(2022年9月1日生效)第四条。
11. 包括人类遗传资源材料和人类遗传资源信息,人类遗传资源材料是指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料。人类遗传资源信息是指利用人类遗传资源材料产生的数据等信息资料。
12. 国务院科学技术行政部门责令停止违法行为,没收违法采集、保藏的人类遗传资源和违法所得,处50万元以上500万元以下罚款,违法所得在100万元以上的,处违法所得5倍以上10倍以下罚款。
13. 个人信息保护影响评估应当包括下列内容:(一)个人信息的处理目的、处理方式等是否合法、正当、必要;(二)对个人权益的影响及安全风险;(三)所采取的保护措施是否合法、有效并与风险程度相适。
14. SMO一般被视为是CRO的细分领域,即更侧重临床现场管理的这一环节。
15. 根据诺思格(301333)及普蕊斯(301257) 上市申报时的招股说明书和法律意见书,发行人保荐机构与律师均持NMPA尚未针对CRO企业/SMO企业实行审批或行业准入政策的观点。
16. 根据《民法典》第859条,委托开发完成的发明创造,除法律另有规定或者当事人另有约定外,申请专利的权利属于研究开发人。研究开发人取得专利权的,委托人可以依法实施该专利。鉴此,若委托合同约定不明,将使得申办者主张对研究成果的所有权存有障碍。
17. 根据《大型医用设备配置许可管理目录 (2018年)》的规定,除10类明确列举的设备外,还有基于价格区间的兜底类规定,首次配置的单台价格区间在3000万元人民币或400万元美金以上的大型医疗器械属于甲类器械,首次配置价格区间在1000-3000万元人民币的大型医疗器械属于乙类器械。
18. 根据联影医疗(688271) 上市申报时的法律意见书,发行人律师分析回应了证监会关注的终端客户未取得配置证的相关法律风险。
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.




